Curiosidades y Desafíos sobre Físico-Químicas
¿Te gusta Físico-Químicas?
¿Te gustaría ver más curiosidades como estas..
O Dióxido de Carbono (CO2) pode se solidificar quando resfriado abaixo de -78 °C, nesse estado é conhecido como....
Ao cortarmos cebolas, duas células presentes nelas são liberadas: uma rica em sulfuretos e outra em enzimas. Quando..
Para neutralizar os efeitos de uma garrafa de Coca-cola, é necessário ingerir 32 copos de água. Esta bebida contém....
Entonces… ¿Qué tal un desafío en la mejor plataforma de cuestionarios del mundo?
Cada escena es una oportunidad para brillar
Conoce un poco de todo y apuesta por tus conocimientos en increíbles desafíos y duelos..
Únete a la comunidad betspot.zone, acumula bts (apuestas) e incluso compite por premios..
Descubre algunos datos interesantes sobre Físico-Químicas..
Quiz física - Curiosidades física - Desafío física - Quiz académico - Curiosidades académico - Desafío académico - Quiz escolar - Curiosidades escolar - Desafío escolar - Quiz química - Curiosidades química - Desafío química - - Preguntas frecuentes sobre Físico-Químicas
El calor es una forma de energía que se transfiere de un cue

El calor es una forma de energía que se transfiere de un cuerpo a otro cuando existe una diferencia de temperatura entre ellos, dando lugar a un equilibrio térmico. La unidad de medida estándar para el calor es el julio (J), aunque es común utilizar calorías (cal) para medirlo. El calor y la temperatura son conceptos distintos, siendo el primero energía y el segundo una medida de la agitación de las partículas en un cuerpo. A lo largo de la historia, el concepto de calor ha sido debatido por filósofos y científicos, desde Aristóteles hasta Lavoisier y Lord Kelvin, quienes establecieron que el calor es una forma de energía. El calor se puede transferir por conducción, convección y radiación, siendo esta última una propagación de ondas electromagnéticas que no requiere de un medio físico para ocurrir, siguiendo la Ley de Steffan-Boltzmann, donde la cantidad de calor emitido es proporcional a la cuarta potencia de la temperatura del cuerpo (Q α T^4).
publicity
El arte de la pirotecnia, que se remonta a milenios

El arte de la pirotecnia, que se remonta a milenios, tiene sus orígenes en la antigua China, donde los nativos arrojaban trozos de bambú verde a las hogueras durante las festividades para ahuyentar a los malos espíritus con sonidos fuertes. Posteriormente, los alquimistas chinos crearon la pólvora mezclando salitre, azufre y carbón vegetal, buscando inicialmente un elixir de vida eterna, pero acabaron utilizándolo en fuegos artificiales. Esta práctica se extendió por Europa y Estados Unidos, convirtiéndose en parte integral de las celebraciones. Originalmente de color naranja, los fuegos artificiales adquirieron colores vibrantes después de que los inventores italianos añadieran metales en 1830. Los colores de los fuegos artificiales están determinados por los compuestos utilizados, como el cloruro de bario para el verde, el magnesio para la plata, el litio para el rojo y el sodio para el amarillo.
La química orgánica es la rama de la química que estudia los

La química orgánica es la rama de la química que estudia los compuestos orgánicos, que contienen carbono en su estructura molecular. Estos compuestos están presentes en la naturaleza y en productos sintéticos fabricados por humanos. La química orgánica se centra en la estructura, propiedades, síntesis y reactividad de los compuestos orgánicos. Las fórmulas estructurales y los grupos funcionales se utilizan para representar e identificar los compuestos. Los temas cubiertos incluyen nomenclatura, estructura y propiedades, síntesis orgánica, mecanismos de reacción y reactividad de grupos funcionales. La química orgánica es fundamental en muchos sectores industriales, como el farmacéutico, el de polímeros, el alimentario, el energético y el químico en general. Su desarrollo contribuye a la sociedad ya la ciencia.
Los cálculos estequiométricos se utilizan en química para de

Los cálculos estequiométricos se utilizan en química para determinar las cantidades de sustancias en una reacción química. Los pasos básicos incluyen: Escribir la ecuación química balanceada para la reacción. Identificar las cantidades conocidas de sustancias involucradas en la reacción. Convierte cantidades conocidas a moles, si es necesario. Utilice la relación estequiométrica de la ecuación balanceada para realizar cálculos de relación. Calcular la cantidad desconocida de la sustancia deseada. Es importante considerar el reactivo limitante, que determina la cantidad máxima de producto formado en la reacción. Los cálculos estequiométricos son útiles para determinar la cantidad de reactivos necesarios, predecir la cantidad de productos formados y resolver problemas relacionados con las cantidades en las reacciones químicas.
publicity
La radiactividad química es un fenómeno en el que los átomos

La radiactividad química es un fenómeno en el que los átomos inestables emiten partículas subatómicas o radiación electromagnética para lograr una mayor estabilidad nuclear. Hay tres tipos principales de radiación: partículas alfa, partículas beta y radiación gamma. Partículas alfa (α): Son núcleos de helio compuestos por dos protones y dos neutrones. Tienen carga positiva y penetración limitada. Partículas beta (β): Son electrones o positrones de alta energía. Tienen menor carga y masa que las partículas alfa y tienen una mayor capacidad de penetración. Radiación gamma (γ): Es una forma de radiación electromagnética sin carga ni masa. Es altamente energético y tiene la mayor capacidad de penetración. La radiactividad se produce en átomos inestables conocidos como isótopos radiactivos, que se transforman en isótopos más estables a través de la desintegración radiactiva. Decaimiento alfa (α), decaimiento beta (β) y emisión de radiación gamma (γ).
La masa molar es una propiedad física que indica la masa de

La masa molar es una propiedad física que indica la masa de una sustancia a escala molecular. Se calcula sumando las masas atómicas de todos los átomos presentes en una molécula o fórmula química. La unidad de medida de la masa molar es gramos por mol (g/mol). Esta unidad indica cuántos gramos de una sustancia están presentes en 1 mol de esa sustancia. Por ejemplo, si la masa molar de una sustancia es de 32 g/mol, eso significa que 1 mol de esa sustancia pesa 32 gramos. Para calcular la masa molar de una sustancia, es necesario conocer las masas atómicas de los elementos que la componen. La masa atómica de un elemento se encuentra en la tabla periódica de elementos. Representa el promedio ponderado de las masas de los isótopos de ese elemento.
O Dióxido de Carbono (CO2)

O Dióxido de Carbono (CO2) pode se solidificar quando resfriado abaixo de -78 °C, nesse estado é conhecido como gelo-seco. Ao ser aquecido à pressão atmosférica, ele passa diretamente para o estado gasoso, sem passar pelo líquido (sublimação). Para que o CO2 se torne líquido, é necessária uma pressão superior a 5 atmosferas. Quando ar quente é soprado sobre o gelo-seco, forma-se uma densa nuvem branca no nível do solo, efeito frequentemente usado em teatros. Sua temperatura de sublimação é de 194,7 K (-78,5 ° C; -109,2 ° F) à pressão atmosférica da Terra. Porém, o seu uso deve ser feito com cautela, pois o contato direto com o sólido extremamente frio pode provocar queimaduras de congelamento. Embora geralmente não seja tóxico, se liberado em locais fechados, pode levar a hipercapnia (níveis anormalmente elevados de dióxido de carbono no sangue).
publicity
Ao cortarmos cebolas

Ao cortarmos cebolas, duas células presentes nelas são liberadas: uma rica em sulfuretos e outra em enzimas. Quando essas células se misturam, ocorre uma reação que produz um ácido chamado sulfênico. Esse ácido é transformado em gáse, , quando em contato com a água, gera uma solução fraca de ácido sulfúrico. Como os olhos estão sempre úmidos, a solução formada causa uma irritação nos olhos, o que provoca as lágrimas. Por isso que choramos ao cortarmos cebolas.
Para neutralizar os efeitos de uma garrafa de Coca-cola

Para neutralizar os efeitos de uma garrafa de Coca-cola, é necessário ingerir 32 copos de água. Esta bebida contém cerca de 10 colheres de chá de açúcar, o que equivale a 100% da ingestão diária recomendada. O ácido fosfórico controla o sabor do açúcar. Dez a vinte minutos após a ingestão, há um aumento na produção de insulina devido ao pico de açúcar no sangue. Após 40 minutos, a cafeína é totalmente absorvida, aumentando a pressão sanguínea, dilatando as pupilas e bloqueando os receptores de adenosina, causando insônia. Cinco minutos depois, a dopamina estimula os centros de prazer no cérebro. Depois de 60 minutos, os ácidos presentes na Coca-cola reagem com os nutrientes, como magnésio, zinco e cálcio, no intestino grosso, sendo eliminados na urina, acompanhados de água e sódio. Por fim, o entusiasmo dá lugar ao cansaço e à irritação devido à falta de açúcar.
Ao inalar hélio, a velocidade de propagação da voz aumenta
Ao inalar hélio, a velocidade de propagação da voz aumenta, resultando em um som mais fino. Isso se deve à leveza do gás, que é aproximadamente 7 vezes mais leve do que o ar formado por 78% de nitrogênio (N2). Por outro lado, inalar um gás mais denso faria com que a voz se propagasse em uma velocidade menor, o que a tornaria mais grave
publicity
Após consumir bebidas alcoólicas

Após consumir bebidas alcoólicas, o álcool é quase totalmente absorvido pelo tubo digestivo e entra na circulação sanguínea. Em jejum, a absorção pode levar de 15 a 20 minutos, podendo variar dependendo da concentração de álcool, composição da bebida, ingestão simultânea de alimentos e leite, entre outros fatores. O álcool é produzido por um processo de fermentação a partir de frutas, mel, caules, cereais como cevada, uva e cana-de-açúcar. As bebidas alcoólicas podem ser fermentadas ou destiladas, sendo que as destiladas são mais graduadas. O álcool é uma substância psicoativa que tem efeitos depressores no sistema nervoso central, afetando o comportamento das pessoas que a consomem. Essa substância também interfere nas capacidades cognitivas e perceptivas, principalmente na visão e audição.
A Naftalina

A Naftalina é um hidrocarboneto que faz parte do grupo dos aromáticos. Ela é usada para prevenir a destruição de fibras naturais, como lã e algodão, por meio de sua capacidade de sublimar, ou seja, mudar do estado sólido para o gasoso, liberando vapores que matam as larvas e traças. Para que isso aconteça de forma segura, é necessário que a substância seja armazenada em embalagens lacradas. Entretanto, quando alguém é exposto diretamente aos vapores da naftalina ou usa roupas que foram expostas a ela, há o risco de desenvolver efeitos nocivos à saúde, tais como anemia hemolítica, inquietação, diarreia, sangue na urina e cataratas nos olhos se houver exposição prolongada.
O Isopreno é um dieno especial
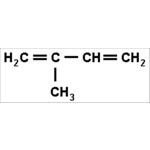
O Isopreno é um dieno especial, muito presente na nossa vida. Sua fórmula molecular é C5H8. Quando ligamos duas ou mais unidades desta molécula, formamos cadeias abertas ou fechadas chamadas Terpenos. Esses Terpenos, ou seus derivados oxigenados, são os principais componentes de óleos essenciais, substâncias coloridas e produtos de borracha. A borracha natural, ou látex, é encontrada na seiva de algumas árvores, como a seringueira, e a sua fórmula repete as unidades de isopreno em uma ordem de 5000. Esta reação de formação da borracha natural resulta na produção de inúmeros produtos feitos de borracha, tais como preservativos, luvas cirúrgicas, balões, borrachas escolares, entre outros.
publicity
O ácido acetilsalicílico, mais conhecido como aspirina
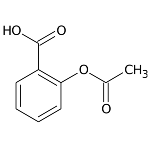
O ácido acetilsalicílico, mais conhecido como aspirina, é um composto orgânico de função mista que oferece excelentes propriedades antirreumáticas, antifebris e analgésicas. Em 1829, o farmacêutico H. Leroux foi o primeiro a isolar a salicina da casca da planta salgueiro. Mais tarde, em 1859, o químico alemão Kolbe sintetizou o ácido salicílico em seu laboratório. Entretanto, esse composto apresentava efeitos desagradáveis, como irritações estomacais. Foi então que, em 1897, o farmacêutico Felix Hoffman obteve o ácido acetilsalicílico, ao realizar uma reação entre o ácido salicílico e o anidrido acético. Desde então, esse composto é utilizado para o tratamento da dor de cabeça, febre reumática e outros males
A Acrilamida, também conhecida como Pop-2-enamida

A Acrilamida, também conhecida como Pop-2-enamida, é uma molécula orgânica do grupo funcional das amidas. Possui três átomos de carbono e uma ligação pi entre dois deles. Comumente encontrada nos alimentos industrializados, ela não é adicionada aos produtos, mas sim originada a partir da reação química entre a asparagina (enzima) e a glicose (carboidrato) quando estes são aquecidos a temperatura igual ou superior a 120°C. Também é presente na fumaça do cigarro. Além disso, a Acrilamida possui aplicações na construção civil, pois pode ser polimerizada em forma de poliacrilamida.
A Anilina
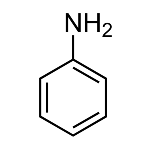
A Anilina é uma substância aromática de benzenoamina que foi isolada pela primeira vez em 1826 com a destilação destrutiva do Índigo. Recebeu esse nome pois a planta de onde foi obtida se chamava Indigofera anil. Geralmente é usada comercialmente por ser barata e poder ser usada na fabricação de diversos tipos de corantes. Quando preparada, ela se apresenta como um líquido incolor oleoso que escurece facilmente quando exposto à luz. Além disso, é tóxica e possui um odor semelhante ao de peixe podre, já que pertence ao grupo das aminas. Por essas características, o nome dela é usado como sinônimo de corante.
publicity
Desde 1847, o triclorometano

Desde 1847, o triclorometano, mais conhecido como clorofórmio, foi usado para fins medicinais como anestésico. No entanto, devido à sua alta toxicidade, esse composto orgânico foi substituído por outras substâncias. Além disso, o clorofórmio foi usado para fins recreativos, como em festas, onde as pessoas inalavam a substância para entorpecer. Hoje em dia, o uso ilegal de drogas como o "loló" e o "lança-perfume", que são compostos predominantemente por clorofórmio e éter etílico, ainda é comum. O consumo desses produtos pode causar euforia, alucinações e tontura, porém também depressão, confusão mental, palidez, convulsões e até coma.
Em 1868

Em 1868, Pierre-Jules-César Janssen percebeu uma linha espectral amarela no Sol que era diferente da do hidrogênio e de qualquer outro elemento conhecido na Terra. O astrônomo inglês Norman Lockyer deu o nome de hélio para este elemento, que permaneceu por 25 anos sem ser descoberto aqui na Terra. Em 1895, William Ramsay tratou gases produzidos pela cleveita com ácidos e enviou para William Crookes e para Lockyer, que percebeu que se tratava do gás hélio. Na Suíça, Per Cleve e seu aluno Nils Abraham Langlet também descobriram o mesmo, sendo assim considerados descobridores do hélio. O hélio é o segundo elemento mais leve e mais abundante no Universo, ficando atrás do hidrogênio. É muito utilizado principalmente para encher balões, principalmente em festas infantis.
A nitroglicerina foi descoberta em 1847 pelo químico italian

A nitroglicerina foi descoberta em 1847 pelo químico italiano Ascanio Sobrero ao reagir a glicerina com uma mistura sulfonítrica. Era muito instável e sua explosão era extremamente violenta, o que impossibilitou o seu uso como explosivo. Em 1867, o químico sueco Alfred Bernhard Nobel conseguiu tornar a nitroglicerina menos sensível a choques ao criar a dinamite, uma mistura de 75% de nitroglicerina e 25% de terra diatomácea. Posteriormente, Nobel também inventou a dinamite gelatinosa e a pólvora sem fumaça. Atualmente, a nitroglicerina tem aplicações na medicina como vasodilatador coronário, sendo prescrita em casos de risco de infarto e de obstrução das artérias.
publicity
Diamantes são uma forma allotrópica de carbono

Diamantes são uma forma allotrópica de carbono, sendo que cada átomo de carbono está ligado a outros quatro, formando uma estrutura que só pode se formar nas camadas mais profundas da Terra, devido às altas pressões e temperaturas. Estes são então expulsos para a crosta terrestre, onde também são criados diamantes sintéticos por meio da modificação da estrutura cristalina da grafita. As diferentes colorações dos diamantes podem ser causadas por impurezas, como nitrogênio para a cor amarela ou boro para a cor azul. Outra causa podem ser deformações da treliça cristalina, resultando em diamantes raros de cor marrom, rosa ou vermelha.
Se colocada na geladeira a pilha pode voltar a funcinar? Bem

Se colocada na geladeira a pilha pode voltar a funcinar? Bem, a reação global da pilha consiste na transferência de elétrons do zinco para o cátodo, que é composto por dióxido de manganês, carvão em pó e uma mistura pastosa de cloreto de amônio e cloreto de zinco. Quando essa reação ocorre, o dióxido é convertido em trióxido de manganês, o que é irreversível. A pilha só funcionará enquanto os elétrons continuarem sendo transferidos para o cátodo. No entanto, ao longo do processo, a amônia (NH3) é liberada, depositando-se na barra de grafita, dificultando a passagem dos elétrons e causando a descarga da pilha. Colocar a pilha na geladeira não o reverterá deste estado e, portanto, não a fará voltar a funcionar.
A Termoquímica ou Termodinâmica Química

A Termoquímica ou Termodinâmica Química é o ramo da química que estuda o comportamento dos sistemas químicos em relação à energia. Ela envolve a análise das mudanças de energia associadas às reações químicas, bem como as equações de estado que descrevem essas relações. A Termodinâmica Química também aborda as propriedades termodinâmicas das substâncias, como entalpia, calor latente, energia livre de Gibbs, entropia e outras, que determinam o equilíbrio químico de um sistema. Essas propriedades podem ser usadas para prever o resultado de reações químicas e para calcular o potencial energético dos sistemas químicos.
publicity
Os fenômenos ópticos acontecem quando luz e matéria se inter
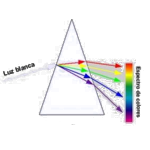
Os fenômenos ópticos acontecem quando luz e matéria se interagem. Reflexão, refração, absorção, dispersão e interferência da luz são os principais fatores responsáveis por esses acontecimentos. A reflexão possibilita que vejamos os objetos ao nosso redor e a refração ocorre quando a luz muda de velocidade ao passar por meios transparentes. A absorção acontece devido a certos pigmentos. Natureza é repleta de eventos ópticos, como Aurora boreal, Miragem, Raios crepusculares, Raios anticrepusculares, Halo solar, Arco-íris, Pilares de luz, Nuvens iridescentes e Cinturão de Vênus. Estes são provas da interação da luz com a matéria, sendo verdadeiros exemplos de maravilhas ópticas.
O som
O som é uma onda longitudinal e mecânica que se propaga em meios materiais como o ar, a água, o metal, etc. É produzido por vibrações capazes de criar áreas de compressão e rarefação nos gases atmosféricos que se alternam de acordo com a frequência da fonte. A velocidade de propagação das ondas sonoras é determinada pela elasticidade do meio, sendo maior quanto mais elástico for. O som apresenta propriedades como velocidade, comprimento de onda, frequência e amplitude. O efeito Doppler, por sua vez, é o aumento ou diminuição da frequência aparente de um som devido ao movimento relativo entre uma fonte sonora e um observador. Podemos calcular a velocidade do som se conhecemos a sua frequência e o seu comprimento de onda.
O calor específico

O calor específico é uma grandeza física intensiva que descreve a variação térmica de uma substância quando recebe uma quantidade de calor. Também conhecido como capacidade térmica mássica, é medido em unidades como J/(kg.K) ou cal/(g °C). O cálculo do calor específico é feito pela fórmula c = Q/m. ΔT ou c = C/m. Além disso, o calor específico molar, também chamado de capacidade calorífica molar, é calculado pela relação entre a capacidade térmica e o número de mols presentes. O calor latente, por sua vez, é a quantidade de calor recebida ou cedida por um corpo, onde sua temperatura permanece a mesma, enquanto seu estado físico se modifica. Esta grandeza é aferida pelo cálculo C = Q/ΔT.
publicity
Os átomos
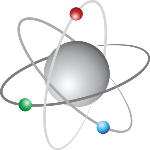
Os átomos são constituídos por três partículas fundamentais: Protões, Neutrões e Eletrões. O núcleo é responsável pela maior parte da massa atômica e a nuvem eletrônica determina o tamanho do átomo. Os átomos podem adquirir ou perder eletrões, formando íons com carga elétrica, como aniões (que ganham eletrões) e cátions (que perdem eletrões). A massa do átomo concentra-se no seu núcleo, pois a massa dos protões e dos neutrões é igual. Isótopos são átomos do mesmo elemento químico, portanto têm o mesmo número atômico, mas diferente número de massa devido ao fato de terem diferentes números de neutrões.
A tabela periódica
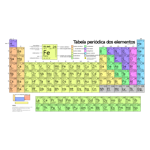
A tabela periódica é um sistema de classificação dos elementos químicos ordenando-os por números atômicos, configurações eletrônicas e padrões periódicos de propriedades. Esta organização evidencia tendências recorrentes, como por exemplo, elementos semelhantes nas mesmas colunas. Existem ainda quatro blocos retangulares que possuem propriedades químicas parecidas. Por norma, na mesma linha (período) os elementos à esquerda são metálicos e os à direita, não-metálicos. Estas linhas são denominadas períodos, enquanto as colunas são chamadas grupos. Além da numeração, cada grupo tem um nome específico, como os halogênios (grupo 17) e os gases nobres (grupo 18). Esta tabela é usada para entender as relações entre as propriedades dos elementos e prever as características de elementos ainda não descobertos ou produzidos. Ela oferece uma base útil para a compreensão do comportamento químico, sendo usada extensivamente na química e outras áreas do conhecimento.
A Força Gravitacional
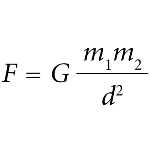
A Força Gravitacional é a interação mútua entre dois corpos que é atrativa e nunca repulsiva. É ela que permite que fiquemos de pé, pois a Terra exerce a força gravitacional sobre os corpos. Esta força faz com que o movimento de translação da Terra aconteça, bem como os outros planetas. A Lei da Gravitação Universal, proposta por Isaac Newton, explica a altura das marés, o ciclo de vida das estrelas e a manutenção dos astros vivos. O peso de um corpo é resultado da ação do campo de gravidade da Terra sobre ele. A força de atração da gravidade é igual ao peso, desprezando a rotação da Terra e a ação da gravidade exercida pelo Sol, Lua e outros astros. A aceleração da gravidade g é de, aproximadamente, 9,83m/s² nas proximidades da superfície da Terra.
publicity
O campo magnético
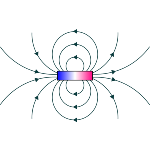
O campo magnético é uma região do espaço que exerce forças sobre cargas elétricas em movimento ou materiais dotados de propriedades magnéticas. Esta grandeza física é medida em tesla (T) e é gerada através da movimentação de partículas carregadas eletricamente, bem como do alinhamento de domínios magnéticos no interior dos ímãs. De acordo com as leis do eletromagnetismo, esses campos magnéticos se originam da variação do campo elétrico. Uma vez que a forma como os domínios magnéticos estão organizados influencia o tipo de magnetismo presente no material, os materiais podem ser classificados como ferromagnéticos, diamagnéticos ou paramagnéticos, dependendo da força com que são atraídos ou repelidos por um campo magnético externo.
O pH
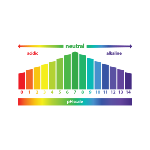
O pH é a medida da acidez ou alcalinidade de uma solução aquosa, com valores que variam de 0 a 14. 0 é o mais ácido e 14 é o mais alcalino, enquanto 7 é neutro, não tendo efeito sobre o sistema. A sigla "pH" significa "potencial de hidrogênio" e é usada para medir a relação entre íons H3O+ e OH- na solução. De acordo com a teoria ácido-base de Arrhenius, ácidos são substâncias que liberam íons hidrônio (H3O+) na água, e bases são substâncias que liberam íons hidroxila (OH-). A água sofre o processo de autoionização, o que significa que ela contém a mesma quantidade de H3O+ e OH- em sua composição, definindo o pH da solução.
Volver
